Протеасомы — крупные внутриклеточные комплексы, с помощью которых клетка избавляется от ненужных белков. Оказывается, фрагмент TDP-43 (белка, участвующего в развитии нейродегенеративных расстройств) способен образовывать вязкий гель, в котором застревают и потому перестают работать протеасомы. Ученые полагают, что это вносит вклад в развитие нейродегенеративного процесса, то есть массовую гибель нейронов.
Модель протеасомы / © free3d
Нейродегенерации — целая группа заболеваний нервной системы, которые постепенно и зачастую незаметно убивают нервные клетки. Самой распространенной нейродегенерацией считают болезнь Альцгеймера, вызывающую нарушения памяти и когнитивных процессов, однако в действительности таких болезней довольно много. Сюда относятся, скажем, фронтотемпоральная деменция, недавно выделенная особая нейродегенерация LATE-NC и боковой амиотрофический склероз (БАС). Стоит отметить, что БАС поражает не головной мозг, а двигательные нейроны спинного — это заболевание получило известность во многом потому, что им страдал Стивен Хокинг.
Установить причины гибели нервных клеток при нейродегенерации не всегда просто, однако огромные усилия исследователей уже позволили многое узнать. Например, в патогенезе всех перечисленных выше болезней в той или иной мере участвует белок TDP-43 (TARDP).
TDP-43 связывает ДНК, о чем исследователям было известно довольно давно. Помимо этого, его молекулы склонны образовывать фибриллы, то есть длинные прочные волокна. А из новой публикации немецких ученых следует, что небольшие фрагменты белка TDP-43 к тому же способны формировать вязкие, напоминающие гель сгустки. Самым интересным оказалось то, что в этой «молекулярной трясине» из TDP-43 застревают и оттого приходят в негодность работающие протеасомы.
Протеасомы — крупные молекулярные машины, предназначенные для утилизации ненужных белковых молекул. При этом для того, чтобы некоторый белок попал в протеасому и подвергся ферментативному расщеплению, он должен сперва получить «метку смерти» — остаток убиквитина. Этот процесс ученые называют убиквитинированием.
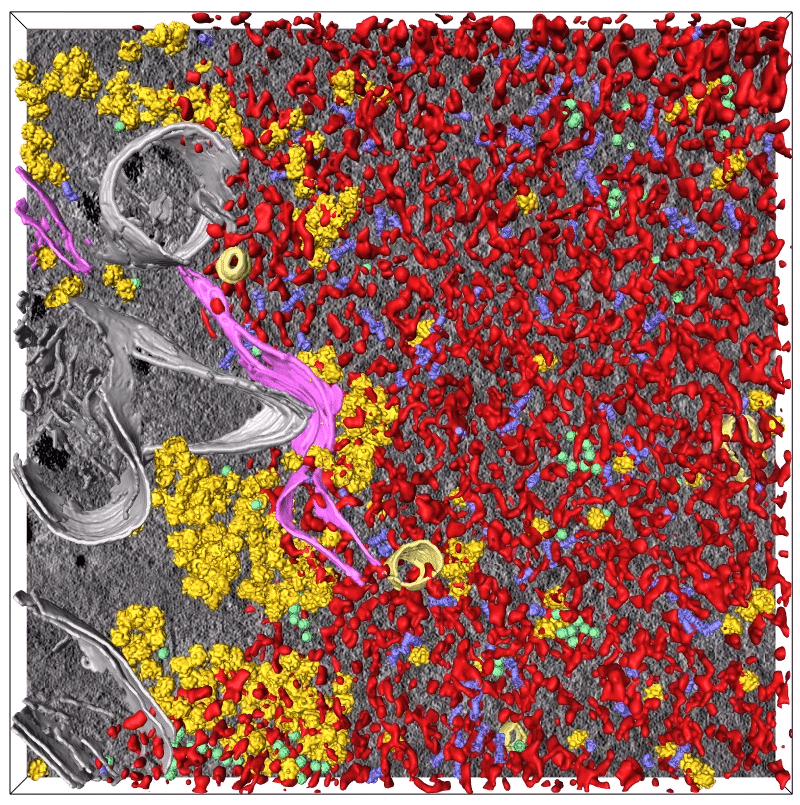 Визуализация данных криоэлектронной микроскопии (синим показаны протеасомы, красным — сгустки TDP-43, желтым — рибосомы) / © Riemenschneider et a.
Визуализация данных криоэлектронной микроскопии (синим показаны протеасомы, красным — сгустки TDP-43, желтым — рибосомы) / © Riemenschneider et a.
Однако увязшие в «жиже» из TDP-43 протеасомы уже не могут устранять нежелательные белки — скажем, имеющие неправильную форму или отработавшие свой ресурс. Исследователи полагают, что вывод протеасом из строя этим белком — один из важных механизмов развития нейродегенеративных расстройств.
Известно, что определенные мутации в кодирующем TDP-43 гене усиливают его способность нарушать «утилизацию» белков и работу протеасом. В частности, такой эффект вызывают все мутации TDP-43, которые связаны с боковым амиотрофическим склерозом.
Чтобы разобраться с этими сложными молекулярными механизмами, ученые использовали флуоресцентные метки и метод криоэлектронной микроскопии (Cryo-EM). По его названию нетрудно догадаться, что он предусматривает глубокую заморозку образца. Действительно, очень низкая температура позволяет проводить исследования в более «естественной» для молекул среде и избежать использование органических растворителей, красителей и тому подобного. В итоге наблюдаемая картина максимально приближена к тому, что происходит в реальной клетке, а разрешение позволяет хорошо различать отдельные атомы.
Новое открытие опубликовано в журнале EMBO Reports и может стать важным вкладом в понимание механизмов нейродегенеративных болезней, а также возможных способов их лечения.