Международная группа ученых обнаружила механизм, позволяющий стволовым клеткам принимать решение о судьбе дочерних клеток еще во время деления. Полученные данные помогут в разработке новых способов стимулирования регенерации тканей для ускорения восстановления после повреждений, а возможно, и для лечения дегенеративных заболеваний.
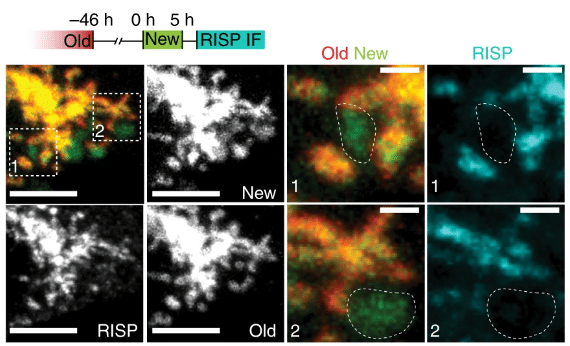
Изображения, полученные на флуоресцентном микроскопе показывают иммунофлуоресцентное (IF) окрашивание белка RISP в митохондриальных доменах, обогащенных старыми или новыми метками. / ©Döhla J., et al., Nature Cell Biology, 2022
Тканевые стволовые клетки содержатся в большом количестве тканей нашего организма. Они отвечают за регенерацию этих тканей и могут стать любой клеткой, характерной для конкретной ткани, в которой она находится. Это свойство называется мультипотентностью, в отличие от плюрипотентности эмбриональных стволовых клеток, которые могут стать любой клеткой всего организма — хоть нейроном, хоть миоцитом (клеткой мышечной ткани).
При делении стволовой клетки образуются две дочерние, которые могут быть как стволовыми, так и дифференцированными клетками ткани. Новая работа исследователей из Университета Хельсинки (Финляндия), а также их коллег из Швеции и Германии посвящена изучению механизма, согласно которому дочерние стволовые клетки определяют, дифференцироваться им или же остаться стволовыми. Точнее, на судьбу дочерних клеток влияет неравномерное наследование митохондрий от родительской клетки.
При изучении деления эпителиальных стволовых клеток ученые обнаружили, что если в дочернюю клетку попадает достаточно много старых, но при этом более активных митохондрий, она теряет способность к самообновлению и дифференцируется в клетку, поддерживающую функцию эпителия. В то же время другая дочерняя клетка, получившая более молодые митохондрии, продолжает жить как стволовая.
Все дело в том, что в недавно синтезированных митохондриях низкий уровень особого железо-серного белка, участвующего в цепи переноса электронов — важном этапе клеточного дыхания. Из-за этого в органеллах глюкоза в большей степени окисляется по альтернативному (относительно стандартного гликолиза) пентозофосфатному пути, что позволяет дочерней клетке оставаться стволовой. Во второй клетке более зрелые митохондрии в полную силу используют обычный гликолиз для окисления глюкозы и получения энергии, что способствует дифференцировке клетки.
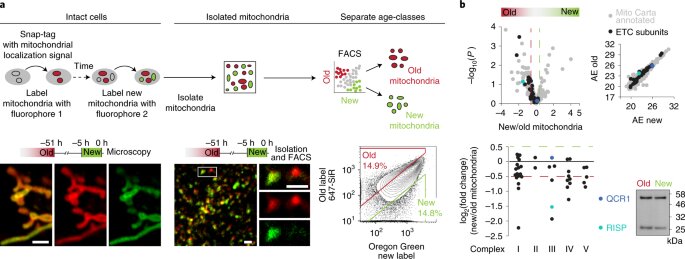 Схематичное описание эксперимента. Новые и старые митохондрии различали при помощи флуоресцентных меток / ©Döhla J., et al., Nature Cell Biology, 2022
Схематичное описание эксперимента. Новые и старые митохондрии различали при помощи флуоресцентных меток / ©Döhla J., et al., Nature Cell Biology, 2022
«Включение генов, определяющих клеточные функции, в итоге определяет и дифференцировку клеток, но метаболизм, по-видимому, служит самым первым фактором, влияющим на их судьбы», — комментирует работу доцент Пекка Катайисто (Pekka Katajisto) из Хельсинкского института естественных наук (HiLIFE) Хельсинкского университета.
«Когда мы ограничили клеточное дыхание, уменьшив количество одного белка, в большом количестве содержащегося в старых митохондриях, дочерние клетки фактически остались самообновляющимися стволовыми клетками», — добавляет доктор-исследователь Джулия Говениус (Julia Govenius) из Хельсинкского университета.
Их работа наглядно демонстрирует, что даже небольшие различия в белковом составе митохондрий могут влиять на метаболизм целых клеток и в итоге на судьбу этих клеток в тканях. Это открытие — часть фундаментального исследования, которое закладывает основу для разработки новых способов стимулирования регенерации тканей (например, при дегенеративных заболеваниях) или для ускорения восстановления после их повреждения.
Статья с результатами исследования опубликована в журнале Nature Cell Biology.


