Исследователи из Кембриджского университета продемонстрировали работу новаторской технологии редактирования генома митохондрий на живых мышах. Она прокладывает путь к новым методам лечения ранее неизлечимых наследственных митохондриальных заболеваний.
Новый метод редактирования генов митохондрий позволит лечить наследственные заболевания / ©Getty Images
Большинство эукариотических клеток, в том числе клетки человека, содержат очень важные органеллы — митохондрии. Их называют энергетическими станциями клетки, поскольку они занимаются окислением органических соединений, при котором высвобождается энергия. Часть этой энергии они запасают в виде АТФ, которая затем используется всей клеткой, а часть рассеивается в виде тепла.
У каждой митохондрии есть собственная кольцевая ДНК, наследуемая исключительно от матери. Всего в клетках человека одновременно присутствуют несколько сот и даже тысяч копий митохондриальной ДНК (мтДНК), по 5-10 копий в каждой митохондрии. Мутации в мтДНК зачастую приводят к наследственным заболеваниям, которые могут проявиться в любом возрасте и затронуть практически любой орган.
Обычно, чтобы мутации в мтДНК проявились клинически, более 60% митохондрий в клетках ткани или органа должны быть дефектными, и чем больше у человека дефектных митохондрий, тем тяжелее будет его болезнь. Частыми клиническими проявлениями митохондриальных заболеваний являются проблемы с развитием и работой мышц (глаз, сердца, скелета), атрофия глазного нерва и ухудшение зрения, судороги, деменция, мигрень, диабет, печеночная недостаточность.
Ранее митохондриальные заболевания считались неизлечимыми, однако было понятно, к чему необходимо стремиться: снизить процент дефектной мтДНК в клетках. Еще в 2018 году команда ученых из отделения митохондриальной биологии Кембриджского университета применила экспериментальное лечение на основе генной терапии на мышах и смогла успешно устранить поврежденную мтДНК в целевых клетках, позволив митохондриям со здоровой ДНК занять их место.
«Наш предыдущий подход был многообещающим, и это первый случай, когда кому-либо удалось изменить митохондриальную ДНК у живого животного, — объяснил доктор отделения митохондриальной биологии Михал Минчук (Michal Minczuk). — Но технология будет работать только в клетках с достаточным количеством здоровой митохондриальной ДНК, которая могла бы копировать себя и заменять дефектную. Это не будет работать в клетках, у которых все митохондрии имеют дефектную ДНК».
В новом исследовании, опубликованном в журнале Nature Communications, Минчук и его коллеги впервые использовали новый биологический инструмент, известный как редактор цитозиновых оснований на основе дезаминазы двухцепочечной ДНК (DdCBE), для редактирования мтДНК в сердце живых мышей.
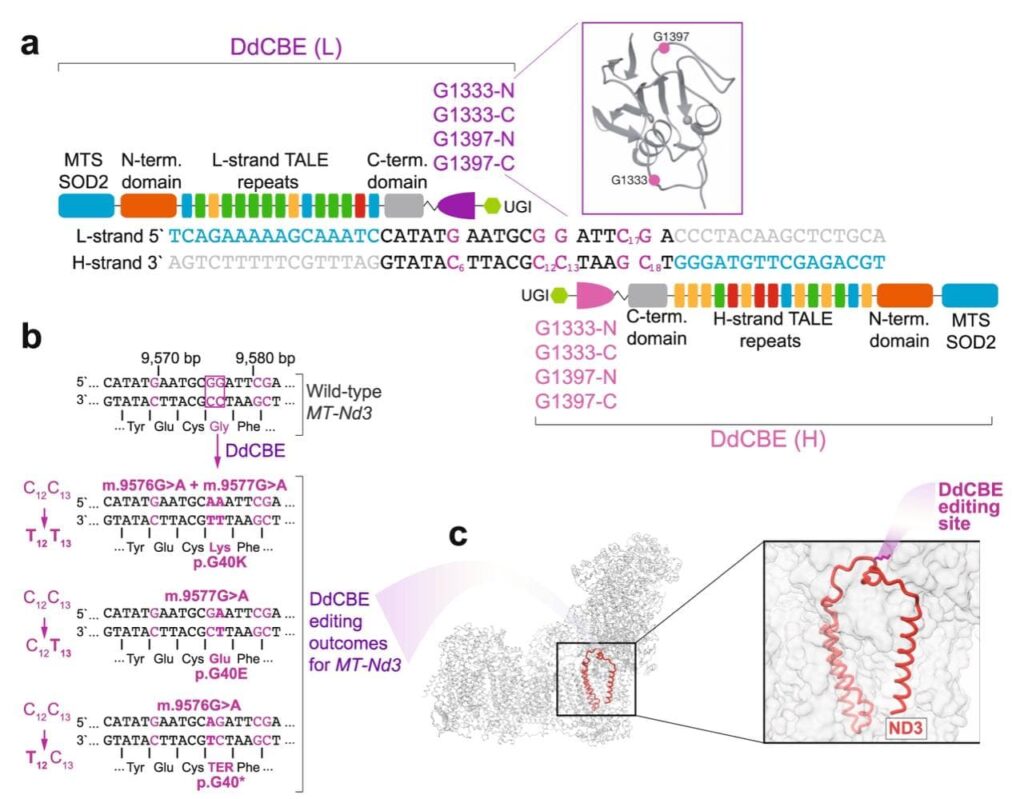 Трехмерная модель мономеров DdCBE и кодирующая ее последовательность ДНК (а). Узнавание участка мтДНК, где необходимо провести замены пар оснований (m.9576G и m.9577G), обеспечивает участок TALE. Также показаны детали и возможные результаты редактирования m.9576G и m.9577G (b). Помимо этого представлена структурная модель комплекса, кодируемого мтДНК, и указана субъединица MT-ND3 (красный), в которой в результате редактирования мтДКН будет заменена аминокислота (с) / Silva-Pinheiro P., et al., 2022
Трехмерная модель мономеров DdCBE и кодирующая ее последовательность ДНК (а). Узнавание участка мтДНК, где необходимо провести замены пар оснований (m.9576G и m.9577G), обеспечивает участок TALE. Также показаны детали и возможные результаты редактирования m.9576G и m.9577G (b). Помимо этого представлена структурная модель комплекса, кодируемого мтДНК, и указана субъединица MT-ND3 (красный), в которой в результате редактирования мтДКН будет заменена аминокислота (с) / Silva-Pinheiro P., et al., 2022
ДНК, кодирующая DdCBE, доставляется до целевых клеток по кровотоку при помощи векторов аденоассоциированного вируса. После синтеза DdCBE в клетке фермент ищет уникальную последовательность пар оснований (C-G, T-A) в мтДНК и катализирует замену пары C-G на пару T-A (в отличие от предыдущего способа, где нуклеотиды вырезались из мтДНК). Такое, казалось бы, простое действие в перспективе позволит избавляться от мутаций, вызывающих сбои в работе митохондрий, и, соответственно, лечить связанные с этим наследственные заболевания.
Педро Сильва-Пиньейро (Pedro Silva-Pinheiro), научный сотрудник лаборатории доктора Минчука и первый автор исследования, добавил: «Это первый случай, когда кому-либо удалось изменить пары оснований ДНК в митохондриях у живого животного. Это показывает, что мы можем исправить ошибки в дефектной митохондриальной ДНК, получая здоровые митохондрии и позволяя клеткам функционировать должным образом».


